1600 – 1661
Nel 1600 con l’introduzione, da parte di Galileo Galilei, del Metodo Sperimentale nella ricerca scientifica, cominciarono ad essere identificati i primi elementi chimici (così definiti da Boyle nel 1661), ovvero le unità fondamentali e non scomponibili in altre sottocategorie delle sostanze.
Man mano che la ricerca chimica venne a scoprire sempre più elementi, fu necessario trovare un criterio logico per classificarli. Questa fu la motivazione alla base del concepimento della Tavola periodica.
- LEGGI ANCHE: Tavola periodica degli elementi, Test
1869
Nel 1869 fu la volta del chimico russo Mendeleev che introdusse una classificazione degli elementi chimici in base al loro Peso Atomico.
1913
Nel 1913 l’olandese Broek e l’inglese Moseley modificarono il sistema di classificazione e lo basarono sul Numero Atomico anziché sul Peso Atomico.
- Peso atomico – Influenzato dal numero di neutroni
- Numero atomico – Influenzato dal numero di protoni
Notazione simbolica degli elementi
La notazione simbolica degli elementi è l’utilizzo dell’iniziale maiuscola in latino per identificare un simbolo

- LEGGI ANCHE: ATOMI E MOLECOLE
Tavola periodica originale, 1869
La Tavola Periodica originale, quella concepita dal chimico russo Mendeleev a metà dell’800, utilizzava la massa atomica, anziché il numero atomico per disporre ordinatamente gli elementi. Quelli erano però tempi in cui ancora però non si erano stati scoperti i protoni, i neutroni e non si era ancora sviluppata la Teoria della struttura atomica.
Tavola periodica definitiva, 1913
L’importanza dei numeri atomici per ordinare la tavola periodica venne individuata solo nel 1913 dal chimico britannico Moseley, il quale, per ovviare al problema di classificare ordinatamente gli elementi chimici che erano anche miscele di isotopi in varie percentuali, decise di non usare come parametro di classificazione in base al Peso Atomico bensì, del Numero Atomico.
Questa opzione consentì di adattare lo schema grafico di Mendeleev alla scoperta di nuovi elementi – già previsti dallo stesso chimico russo che aveva lasciato per loro degli spazi vuoti in grafica – fornendo una sequenza definitiva.
In seguito, la storia scientifica si fece sempre più ricca di nuove scoperte di elementi chimici:
- 1885-90 – scoperta dei gas nobili o gas rari – che fece aggiungere una settima colonna a destra;
- 1920 – la tavola venne ristretta a 18 colonne
- 1943-51 – vennero rappresentati i lantanidi e gli attinidi in due righe diverse del blocco f

Organizzazione degli elementi
In natura esistono 92 elementi chimici che per classificarli sono stati organizzati in uno schema grafico chiaro e preciso: la Tavola Periodica degli elementi o Tavola di Mendeleev.
Gli elementi rappresentati sono classificati in base al Numero Atomico, un valore che permette di conoscere le loro le proprietà chimiche.
La tavola si dice “periodica” perché le proprietà degli elementi si ripetono “periodicamente” nella rappresentazione grafica a seconda della posizione occupata.
Analizzando nel dettaglio la tavola periodica è possibile individuare subito tre categorie di elementi:
- 7 file orizzontali, dette periodi;
- 18 colonne verticali, dette gruppi;
- 2 file separate, per i lantanoidi e gli attinoidi
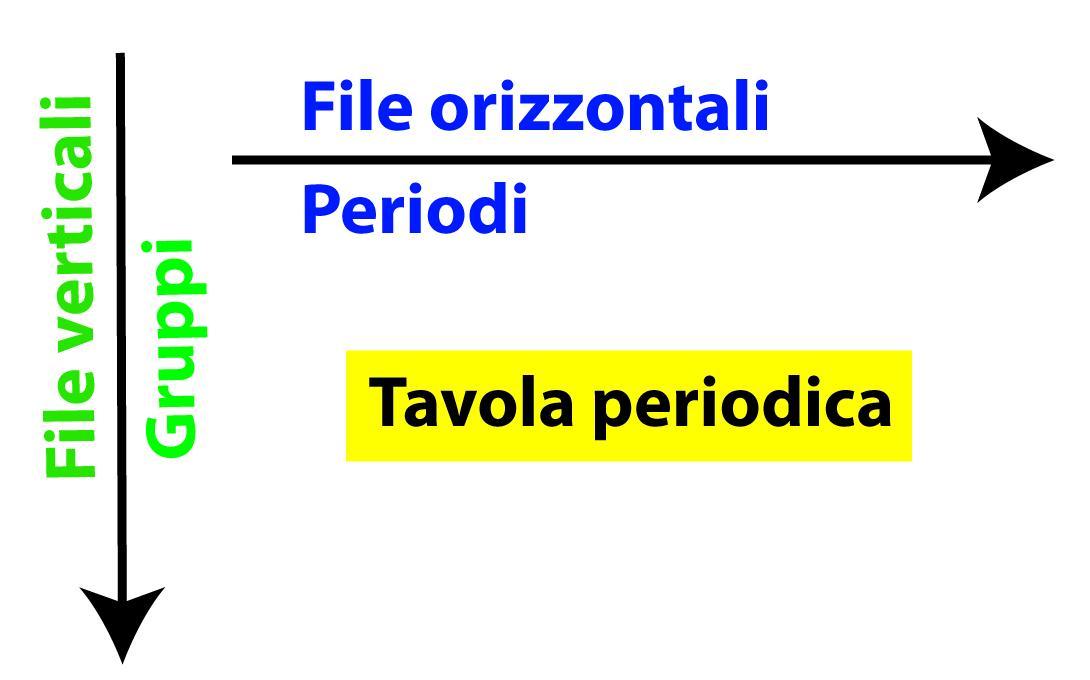
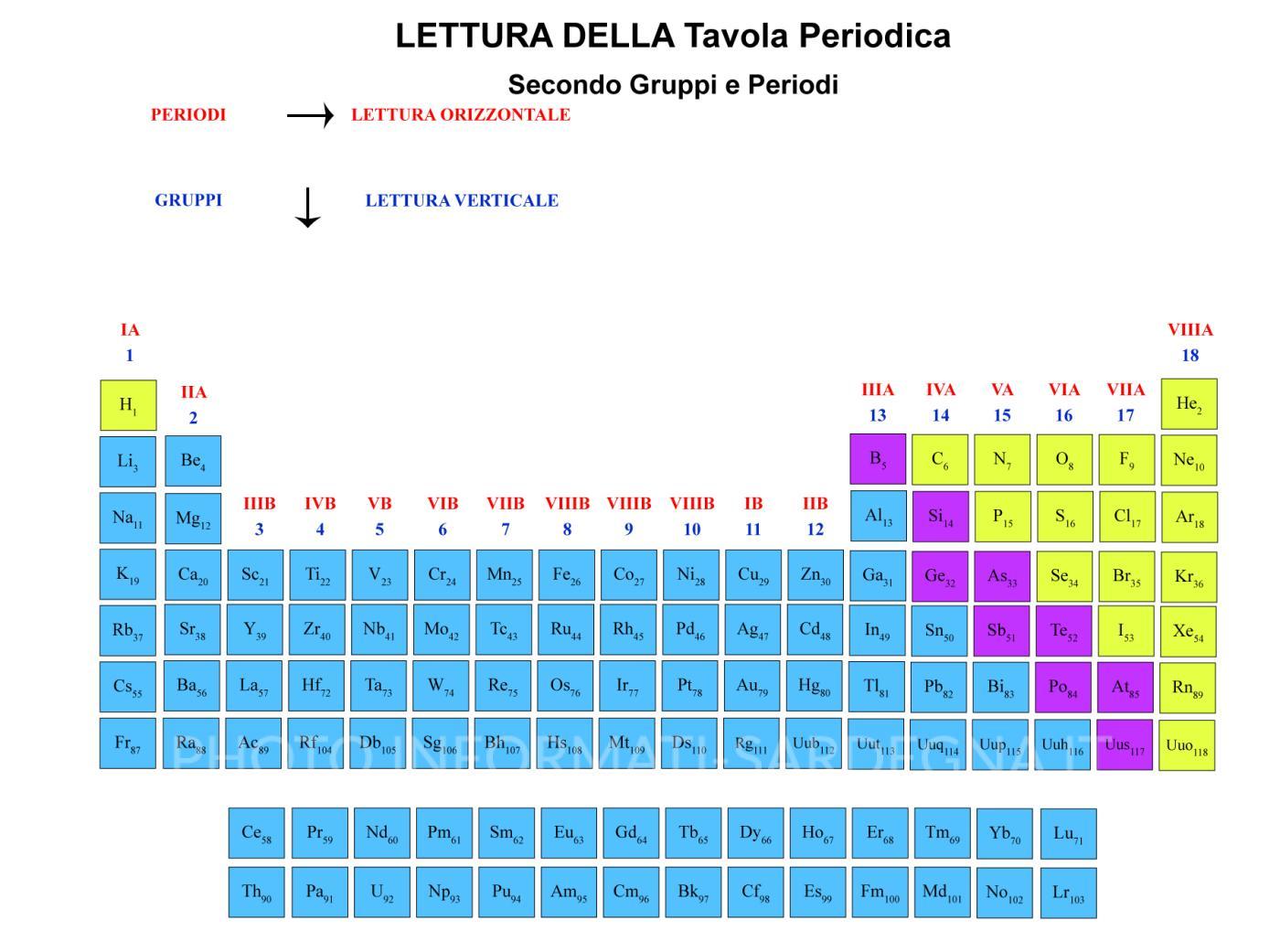
Lettura verticale
Gli elementi di ogni gruppo (lettura verticale) hanno un comportamento chimico simile, mentre il comportamento è diverso tra elementi appartenenti ad uno stesso periodo (lettura orizzontale).
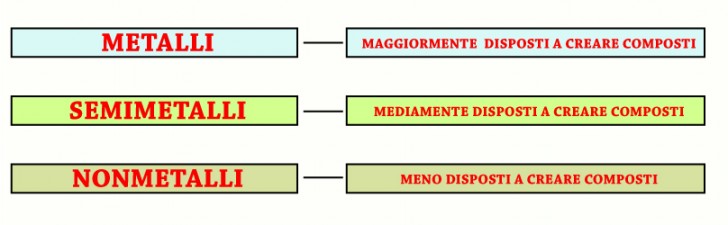

Legami chimici
Tutti gli elementi, esclusi i gas nobili, partecipano a formare i composti.
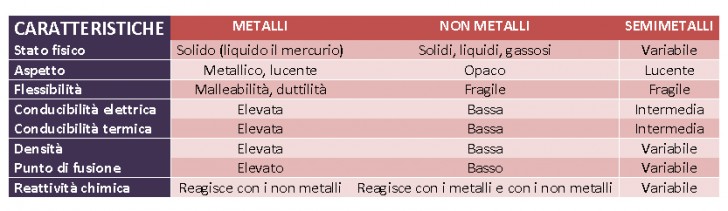
Alcuni, come i metalli, sono particolarmente ” disposti” a formare composti perché hanno gli elettroni degli ultimi orbitali instabili e facilmente trasferibili da un elemento all’altro; i non metalli hanno invece la più ridotta “disponibilità ” a legarsi con altri elementi e infine, i semimetalli hanno una disponibilità a creare composti che è una via di mezzo tra metalli e non metalli.
- Metalli – Molto disposti a formare composti
- Metalloidi (o semimetalli) – Via di mezzo
- Non metalli – Poco disposti a formare composti
- Gas nobili – Non disposti a formare composti
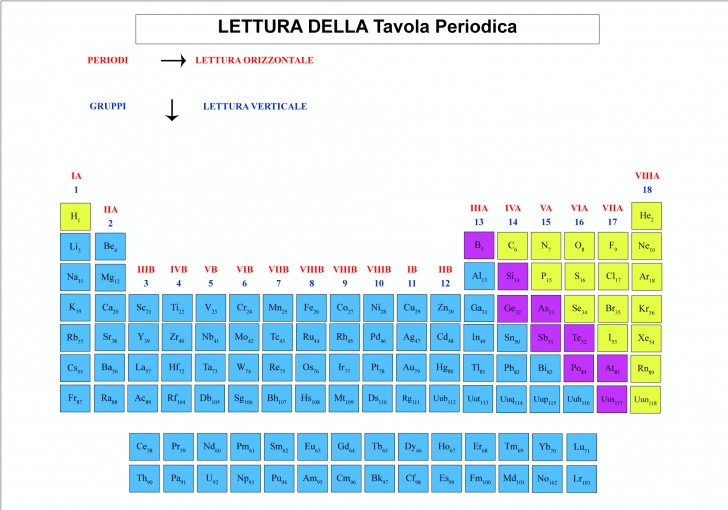
Lettura della Tavola periodica
Approfondendo la lettura della tavola periodica bisogna individuare le aree specifiche di raggruppamento:
- lettura orizzontale – secondo i Periodi
- lettura verticale – secondo i Gruppi
- lettura separata – elementi che possono legarsi/elementi che non possono legarsi
Lettura orizzontale della Tavola Periodica
Suddivisione in periodi
La suddivisione in Periodi della Tavola Periodica mette in vista tre periodi:
- i metalli
- i non metalli
- i semimetalli
Metalli
I metalli sono situati a sinistra della tavola periodica (colore blu chiaro) e sono gli elementi chimici più numerosi, oltre 80. A temperatura ambiente i metalli si trovano quasi tutti allo stato solido, tranne il mercurio che è liquido.
I metalli fanno parte della serie basica dei composti; possono reagire con l’ossigeno dando luogo agli ossidi-basici, i quali, a loro volta, reagendo con l’acqua formano gli idrossidi.
- LEGGI ANCHE: I METALLI PESANTI
- LEGGI ANCHE: I MINERALI
Conducibilità dei metalli
Da un punto di vista chimico i metalli hanno la tendenza a perdere facilmente gli elettroni, specialmente i metalli alcalini e gli alcalini-terrosi.
Questa peculiarità conferisce loro un alto livello di conducibilità elettrica che è tanto maggiore quanto maggiore è il livello di purezza del cristallo.


 Elettroni di valenza
Elettroni di valenza
Negli orbitali più esterni degli atomi che compongono i cristalli si trovano gli elettroni soggetti al trasferimento o alla compartecipazione – i cosiddetti “elettroni di valenza” – che servono per saldare il legame con atomi diversi e realizzare il composto.
Metalli di transizione
Gli atomi più “disposti” a formare legami con altri atomi e ottenere composti, sono quelli che hanno uno o due elettroni all’ultimo orbitale, cioè i metalli. Mentre, gli atomi che hanno sei o sette elettroni, sono più stabili e hanno meno “predisposizione chimica” a formare legami con altri atomi per ottenere composti. Questi atomi perdono la caratteristica metallica e acquisiscono quella non-metallica.
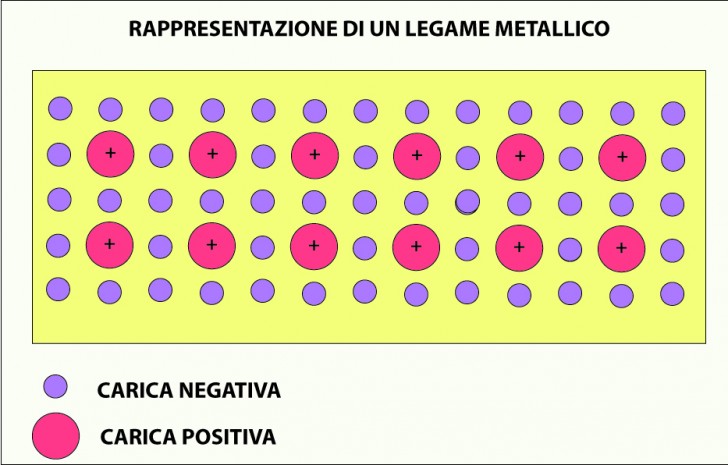
Ad avere caratteristiche spiccatamente metalliche, sono dunque prima di tutto i metalli di transizione, che sono quel gruppo di quaranta metalli che occupano i gruppi da 3 a 12 della Tavola Periodica, cioè la sua parte centrale. Questi elementi avendo l’ultimo orbitale incompleto tendono a dar luogo a elevata coesione (legame metallico) e quindi ad avere temperatura di fusione e proprietà meccaniche elevate che conferiscono loro grande importanza tecnologica.
Legame metallico
Da un punto di vista fisico il legame metallico di questi elementi è dovuto alla interazione attrattiva elettrostatica che si stabilisce tra gli elettroni e i protoni.
- LEGGI ANCHE: I METALLI

Non metalli
I non metalli sono quegli elementi chimici che si trovano nella parte destra della Tavola Periodica (colore giallo), tranne l’Idrogeno che sta in alto a sinistra.
Alla categoria dei non metalli appartengono anche i gas nobili che, per la loro struttura elettronica, sono inerti e hanno una bassa reattività. I non metalli fanno parte della serie acida dei composti che reagendo con l’ossigeno danno formano gli ossidi acidi, i quali, reagendo con l’acqua danno origine agli acidi ternari.
Semimetalli
I semimetalli sono infine la categoria degli elementi chimici presenti nella Tavola Periodica che si trovano lungo la diagonale che unisce il Boro con l’Astato, tra il lato destro e il centro della tavola. In colore fuxia nella grafica sopra.
I semimetalli hanno la caratteristica chimica di essere una via di mezzo tra la basicità dei metalli e l’acidità dei non metalli. I semimetalli sono infatti delle sostanze anfotere (= dal greco ἀμϕότερος che vuol dire «l’uno e l’altro di due»), hanno cioè la capacità di comportarsi come metallo (basico) o come non metallo (acido), a seconda della sostanza con cui reagiscono.
Dal punto di vista della conducibilità elettrica i semimetalli sono dei semiconduttori, hanno cioè una migliore prestanza rispetto agli isolanti, ma non la conducibilità dei metalli. Anche sui versanti dell’elettronegatività e della energia di ionizzazione i semimetalli hanno valori intermedi tra metalli e non metalli.
Materiali isolanti – Non metalli
Materiali conduttori – Metalli
Lettura verticale della Tavola Periodica
Gruppi della Tavola periodica
La lettura orizzontale della Tavola Periodica prevede la suddivisione degli elementi in Gruppi.
Che sono:
- Gruppo 1 (I) – Metalli alcalini (escluso l’Idrogeno)
- Gruppo 2 (II) – Metalli alcalino terrosi
- Gruppo 16 (VI) – Elementi calcogeni
- Gruppo 17 (VII) – Alogeni
- Gruppo 18 (VIII) – Gas rari o nobili

I metalli di transizione si trovano nella parte centrale della tavola:
- 1a serie – Da Z = 21 (Sc) a Z = 30 (Zn)
- 2a serie – Da Z = 39 (Y) a Z = 48 (Cd)
- 3a serie – Da Z = 57 (La) a Z = 80 (Hg)
Nella parte bassa della tavola vi sono infine gli elementi di transizione interna:
- Da Z = 58 (Ce) a Z = 71 (Lu) → Lantanoidi
- Da Z = 90 (Th) a Z = 103 (Lr) → Attinidi
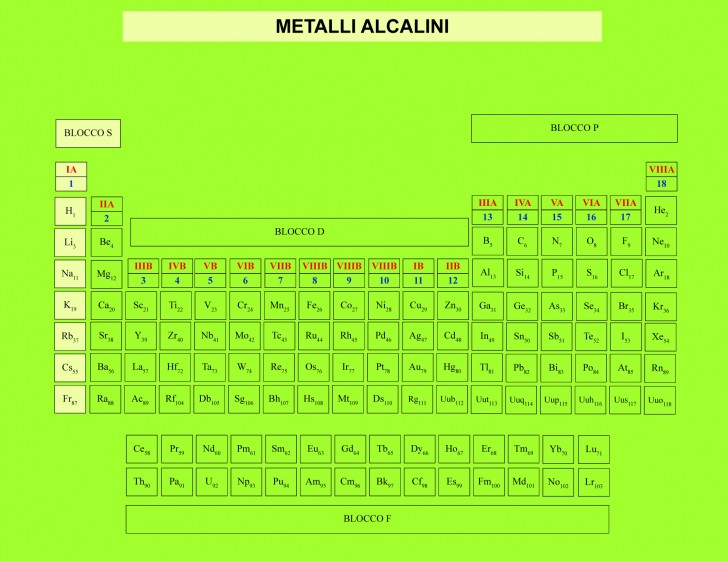
Metalli alcalini
I Metalli alcalini (dall’arabo al-qily ‘potassa, che vuol dire friggere o arrostire) sono quegli elementi chimici con spiccate caratteristiche basiche che appartengono al gruppo 1 del blocco s della tavola periodica.
In precedenza tale gruppo era l’IA e riguarda l’insieme di metalli molto reattivi, capaci cioè di perdere facilmente il loro elettrone dell’orbita più esterna e di formare dei cationi M+.
 Questi elementi hanno caratteristiche spiccatamente basiche
Questi elementi hanno caratteristiche spiccatamente basiche
Tra gli elementi più importanti figurano il sodio e il potassio perché formano i composti chimici essenziali per l’organismo animale.
Proprietà dei metalli alcalini
- – aspetto metallico lucente
- – teneri e duttili perché dispongono di un solo elettrone nell’orbita esterna da utilizzare nel legame metallico
- – densità bassa
- – punto di fusione bassi
- – punto di ebollizione basso
- – bassa energia di ionizzazione del primo livello perché il solo elettrone esterno viene perso facilmente
- – altissima energia di ionizzazione del secondo livello tanto che gli ioni M2+ non si trovano in nessun composto
- – bassi livelli di elettronegatività per la facilità con cui perdono l’elettrone più esterno
- – sono metalli assai elettropositivi (si ossidano facilmente)
- – hanno elevata conducibilità termica
- – hanno elevata conducibilità elettrica

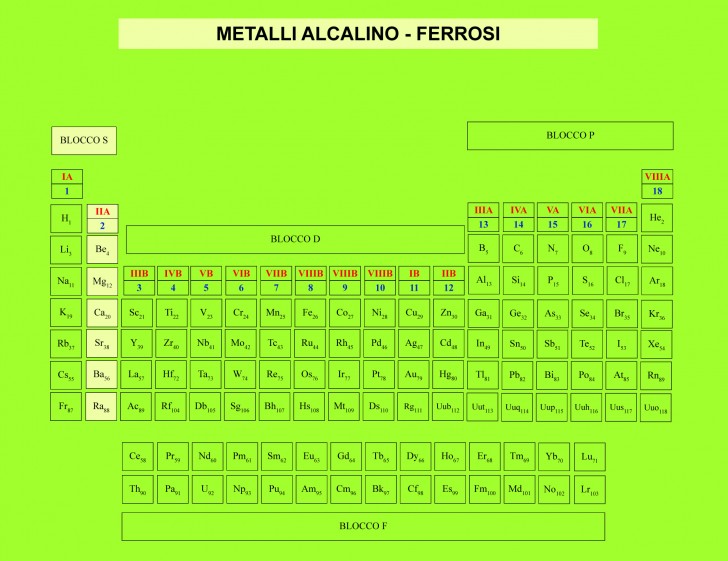
Metalli alcalino terrosi
 I metalli alcalino terrosi, chiamati così perché si comportano come le “terre”, cioè non si alterano col calore (secondo gli antichi chimici), appartengono al gruppo 2 del blocco s nella tavola periodica che nella nomenclatura passata facevano parte del gruppo IIA.
I metalli alcalino terrosi, chiamati così perché si comportano come le “terre”, cioè non si alterano col calore (secondo gli antichi chimici), appartengono al gruppo 2 del blocco s nella tavola periodica che nella nomenclatura passata facevano parte del gruppo IIA.
Si tratta di metalli molto reattivi, capaci di perdere facilmente i due elettroni che si trovano nel loro orbitale più esterno formando cationi M2+.
I metalli alcalino-terrosi hanno gli atomi più piccoli del gruppo 1 ma di dimensioni comunque elevate e una maggiore energia di ionizzazione perché le dimensioni sono più piccole e la carica nucleare è maggiore.
L’energia di terza ionizzazione è altissima tanto che ioni M3+ non si formano mai; mentre hanno un’energia di seconda ionizzazione è abbastanza bassa da essere compensata dall’energia reticolare e quindi gli elementi di questo gruppo nei loro composti si presentano come cationi M2+.
Proprietà dei metalli alcalino-terrosi
- – aspetto metallico lucente
- – relativamente meno teneri e duttili rispetto al gruppo 1
- – Densità più elevati del gruppo 1
- – punto di fusione più elevati del gruppo 1
- – punto di ebollizione più elevati del gruppo 1
- – bassa energia di ionizzazione del primo e secondo livello
- – altissima energia di ionizzazione del terzo livello tanto che gli ioni M3+ non si trovano in nessun composto
- – ancora bassi livelli di elettronegatività (ma più alti del gruppo 1) per la facilità con cui perdono i due elettroni più esterni
- – sono metalli assai elettropositivi (si ossidano facilmente)
- – hanno elevata conducibilità termica (ma più bassa del gruppo 1)
- – hanno elevata conducibilità elettrica (ma più bassa del gruppo 1)
Calcogeni
 Gli elementi calcogeni, “calcogeno” vuol dire “generatore di minerali” e indica la specificità del gruppo a cui appartengono, il gruppo 16 della Tavola periodica, un tempo denominato VIA.
Gli elementi calcogeni, “calcogeno” vuol dire “generatore di minerali” e indica la specificità del gruppo a cui appartengono, il gruppo 16 della Tavola periodica, un tempo denominato VIA.
Tale specificità riguarda il fatto che quasi tutti i più importanti minerali da cui si estraggono metalli sono solfuri o ossidi e anche al fatto che oltre il 99% dei minerali comuni sono telluri, seleniuri, solfuri o ossidi.
I calcogeni più leggeri sono essenziali per la vita, mentre quelli più pesanti sono tossici. Tra essi l’ossigeno è il più comune. Usato nella fabbricazione dell’acciaio, viene estratto dall’aria.
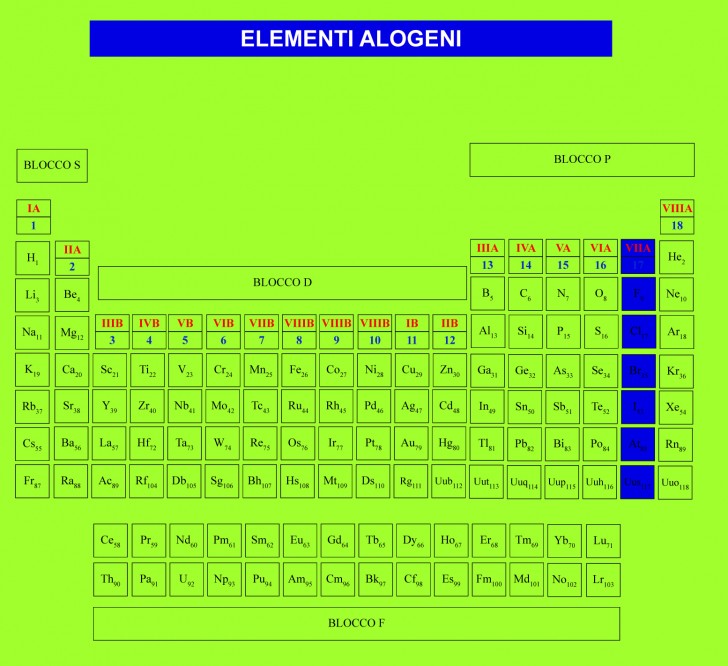
Alogeni
Gli elementi alogeni – da “alogeno” che vuol dire “generatore di sali” -, nella nomenclatura precedente facevano parte del gruppo VIIA e hanno la caratteristica di reagire con quasi tutti gli elementi chimici, formando composti ionici o covalenti usati poi come base per altri composti.
 Tra questi elementi il più noto è certamente il fluoro, che è l’alogeno più diffuso nella crosta terrestre (13° elemento). C’è poi il cloro, 20° elemento per abbondanza nella crosta terrestre; il bromo e lo iodio, meno abbondanti (rispettivamente 62° e 65°).
Tra questi elementi il più noto è certamente il fluoro, che è l’alogeno più diffuso nella crosta terrestre (13° elemento). C’è poi il cloro, 20° elemento per abbondanza nella crosta terrestre; il bromo e lo iodio, meno abbondanti (rispettivamente 62° e 65°).
Gli alogeni sono generalmente tossici e tra loro il fluoro, tossico soprattutto nella forma elementare viene usato in piccole dosi per la fabbricazione di dentifrici; il cloro invece tossico nella forma gassosa sotto forma di ione cloruro entra nell’alimentazione come NaCl, il sale da cucina.
Proprietà degli elementi alogeni
I metalli alogeni allo stato elementare formano molecole biatomiche volatili. A differenza di quanto si osserva nei precedenti gruppi 13-16, gli alogeni formano gruppi omogenei, simili al primo gruppo. Le dimensioni atomiche, la temperatura di fusione e quella di ebollizione crescono progressivamente lungo il gruppo, cosicchè il fluoro e il cloro sono allo stato gassoso; mentre il bromo è liquido e lo iodio solido.
Gli alogeni hanno la maggiore elettronegatività della tavola periodica che diminuisce man mano che aumenta il numero atomico.
Gli alogeni formano composti ionici o covalenti con quasi tutti gli elementi e per questo vengono molto spesso usati come basi di partenza per la sintesi di composti organici o inorganici.
- LEGGI ANCHE: LA METALLURGIA
Conducibilità ed elettronegatività
Elettronegatività = tendenza di un atomo ad attrarre verso di sé elettroni condivisi
- METALLI – Bassa elettronegatività / Elevata conducibilità
- NON METALLI – Alta elettronegatività / Bassa conducibilità
L’atomo meno elettronegativo perde elettroni e si trasforma in ione positivo (catione) mentre, l’atomo più elettronegativo acquista elettroni, divenendo ione negativo (anione).
Autore articolo: Pierpaolo Spanu








