Tutta la materia è costituita da atomi, le piccole particelle invisibili anche al microscopio elettronico.
- LEGGI ANCHE: Atomi e Molecole, Test
Fino ad ora si è potuto stabilire l’esistenza di 118 atomi diversi (o elementi), 96 dei quali sono naturali e 21 sono artificiali.
La Tavola Periodica
La Tavola Periodica è la catalogazione ufficiale mondiale in cui sono ordinati e classificati tutti gli atomi conosciuti dall’uomo. La Tavola ovviamente subisce modificazioni e aggiornamenti continui perché rappresenta il polso grafico delle nuove scoperte nel campo della chimica.
Dal 1869 la Tavola Periodica degli Elementi ha continuato a dare spazio a nuovi elementi scoperti. E così, nel 2016 è stato completata la settima riga aggiungendo quattro nuovi elementi fino al numero atomico 118 con l’oganesson (denominato prima ununoctium).
1869
Anno di nascita della
Tavola Periodica
2016
Ultimo atomo scoperto
e inserito nella Tavola Periodica
- LEGGI ANCHE: La Tavola Periodica
Origine della parola atomo
La parola “atomo” deriva dal greco “atomus” (a-tomos / a – divisibile) che vuol dire “indivisibile“.
ATOMO → A / THOMOS → indivisibile
Il primo a ipotizzare l’esistenza degli atomi da un punto di vista chimico fu lo studioso inglese John Dalton nel 1808. Dal punto di vista concettuale tuttavia già in ambito filosofico l’atomo era stato teorizzato nell’Antica Grecia, quando il filosofo Democrito aveva parlato dell’esistenza di particelle elementari e indivisibili che costituivano la materia.
1808
Prima teorizzazione dell’atomo
- LEGGI ANCHE: La filosofia presocratica
Misurazione degli atomi
Per indicare le dimensioni degli atomi, delle molecole e dei legami chimici si usa come unità di misura l’ångström (Å) che corrisponde a 0,1 nm o 1à—10−10 m.
ångström (Å)
Unità di misura dell’Atomo
- Gli atomi hanno un raggio che varia da 0,25 e 3 Å…;
- I legami chimici hanno un raggio che varia da 0,75 a 2 Å….
L’ångström (Å) , o angstrom non appartiene al Sistema internazionale di misura.
A scale così piccole le leggi della meccanica e della fisica classica non sono applicabili e dunque i movimenti delle particelle elementari non possono essere descritti con queste teorie.
Rappresentazione degli atomi
Per indicare gli elementi chimici si adotta un sistema internazionale di simboli. Secondo tale sistema ad ogni elemento è attribuito un simbolo, rappresentato dalla prima lettera in maiuscolo del nome in latino. In alcuni casi per evitare confusione, in nomi che hanno la stessa lettera iniziale, si aggiunge una seconda lettera in minuscolo.
Il simbolo di un elemento rappresenta un atomo di quell’elemento.
- → H → Hydrogenum → Idrogeno;
- → Ca → Calcium → Calcio
Molecole
La maggior parte degli atomi (o elementi) ha la capacità di unirsi chimicamente, cioè di legarsi ad altri atomi per formare delle unità più complesse dette molecole.
Le molecole degli elementi possono essere costituite da atomi di uno stesso tipo (es: O2 = due atomi di Ossigeno), dette molecole propriamente dette, oppure da atomi di diverso tipo dette composti (H2O).
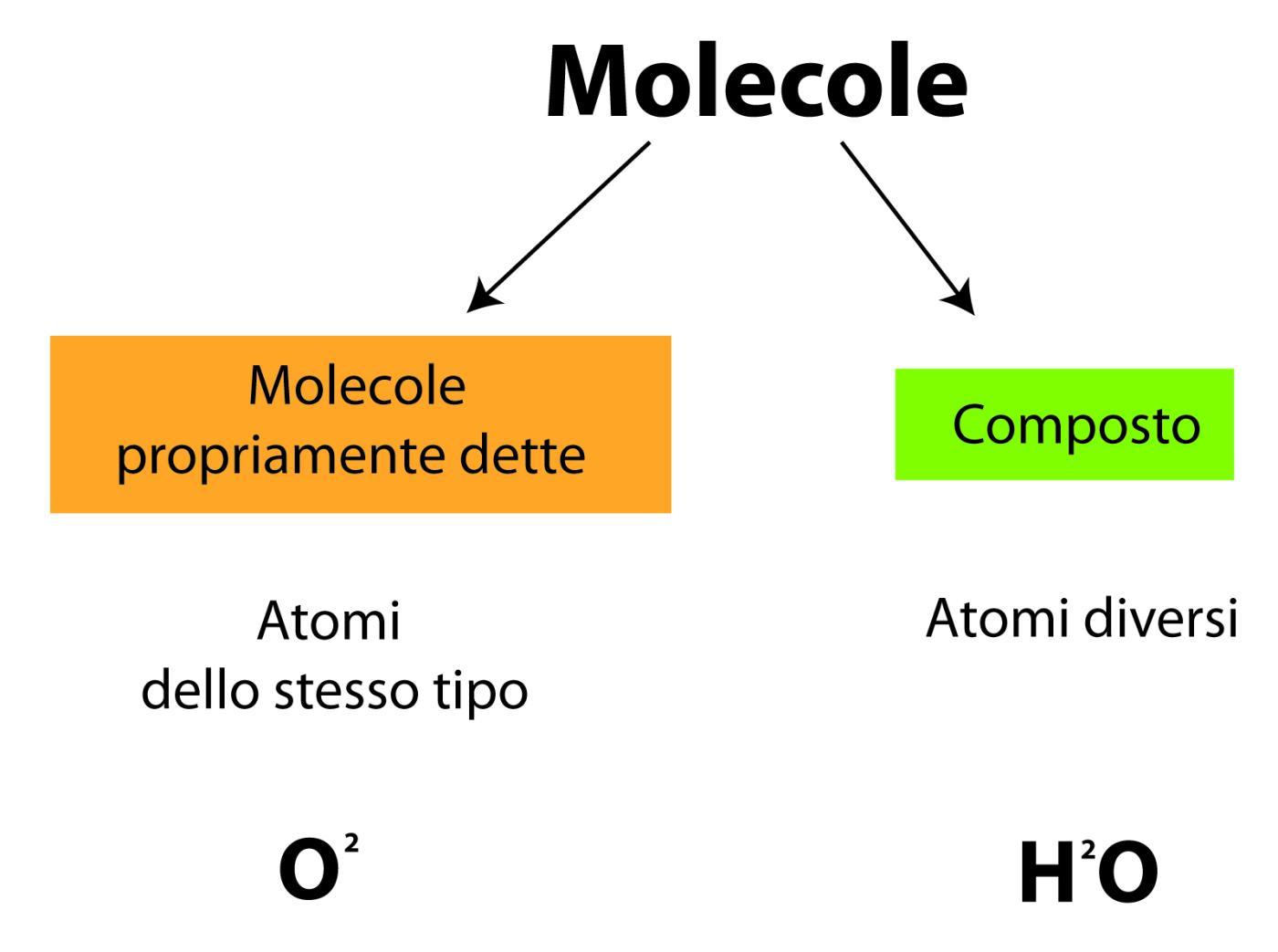
Rappresentazione di una molecola
La struttura di una molecole o di un composto si rappresentata mediante una formula, in cui compare il simbolo di ciascun elemento a cui viene aggiunto in basso a destra il numero arabo che indica il numero di atomi di quella specie presenti.
Se la formula indica solo quanti e quali atomi dei singolo elementi sono presenti in sostanza, si parla di formula bruta o grezza; se invece la formula dà informazioni – attraverso una rappresentazione grafica stilizzata – sulla disposizione dei vari atomi uno rispetto all’altro, si parla allora di formula di struttura.
Ad esempio:
- Formula grezza del Glucosio: C6H12O
- Formula di struttura del Glucosio:
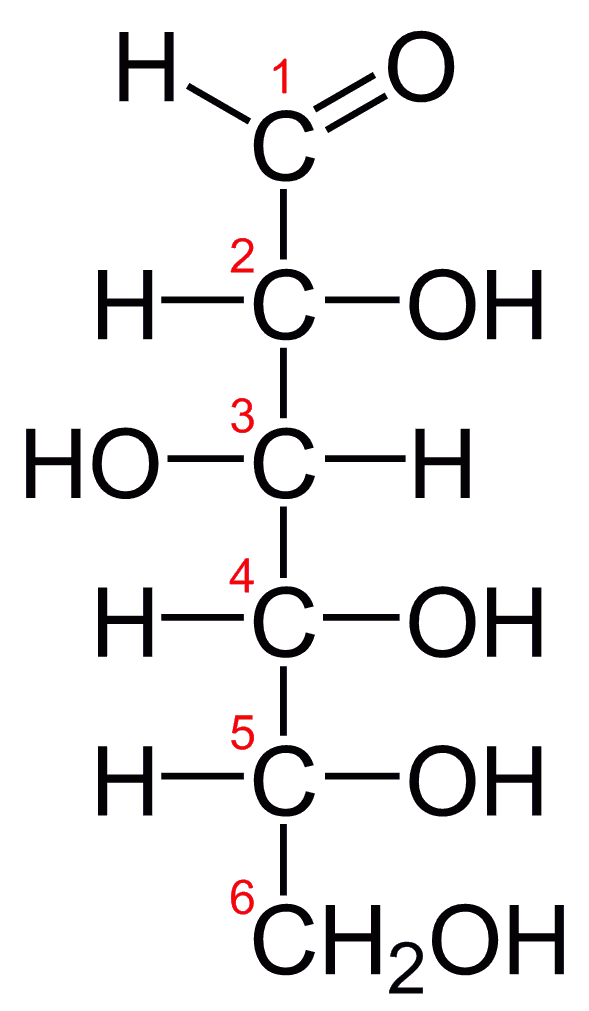
Struttura dell’atomo
Per spiegare la struttura degli atomi e giustificarne certe peculiarità nel corso della storia della didattica scientifica sono stati proposti dei modelli atomici e, tra i più usati, vi sono quelli di Thompson (1904) e di Bohr (1913).
Particelle elementari dell’atomo
L’atomo non è la più piccola unità di materia, inferiore ad esso ci sono infatti le particelle elementari o particelle subatomiche che lo costituiscono: il protone, il neutrone e l’elettrone.
- L’elettrone – particella dotata 1836 volte più piccola dell’atomo di idrogeno (l’atomo più leggero), ha carica negativa. Essendo la più piccola quantità di elettricità disponibile in natura, la carica dell’elettrone è assunta come carica unitaria o elementare.
- Il protone – è una particella dotata di massa pari a quella dell’atomo di idrogeno; ha carica positiva.
- Il neutrone – è una particella di massa pari a quella del protone ed ha carica nulla.
Dimensioni
- ELETTRONE – 1836 volte più piccolo dell’atomo di idrogeno
- PROTONI E NEUTRONI – Dimensioni pari all’atomo di idrogeno
Nucleo dell’atomo
Il nucleo occupa una minima parte del volume dell’atomo. All’interno del nucleo sono ospitati i protoni e i neutroni, mentre all’esterno si trovano gli elettroni.

Massa dell’atomo
Numero atomico
Essendo la massa degli elettroni molto piccola, si considera approssimativamente la massa atomica solo pari al numero di protoni. Il numero di protoni (e quindi la massa dell’atomo) è espressa col numero atomico (Z).
- Tutti gli atomi di uno stesso elemento hanno sempre lo stesso numero di protoni;
- Il numero dei protoni del nucleo di ciascun elemento aumenta di un’unità man mano che si passa dall’atomo più semplice a quello più complesso
- Il numero di neutroni può variare in atomi dello stesso elemento.
- ISOTOPI = Atomi con lo stesso numero atomico e con numero di neutroni diverso si chiamano isotopi.
- NUMERO DI MASSA (A) = numero dei protoni + numero dei neutroni. Il numero di massa indica il Peso Atomico.
NUMERO ATOMICO (Z) – Numero dei protoni
NUMERO DI MASSA (A) – Numero dei protoni e dei neutroni
Rappresentazione di un atomo
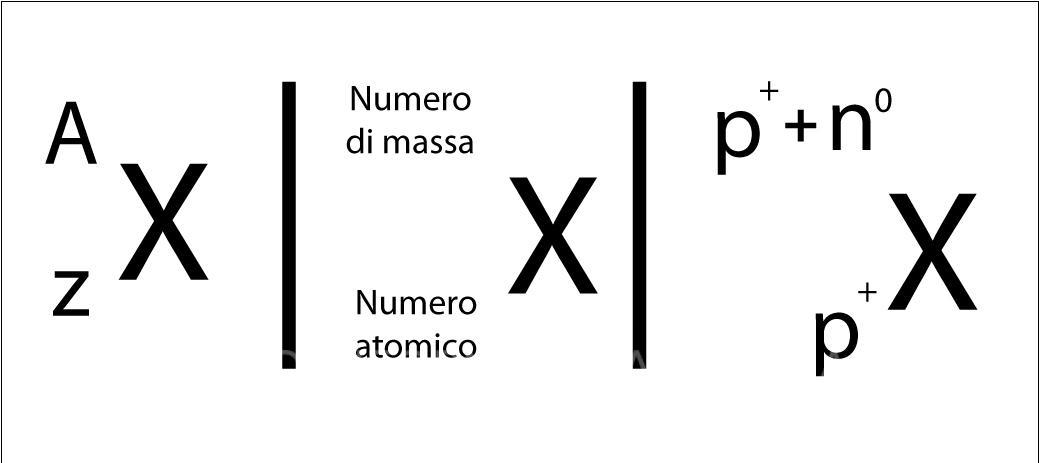
Isotopo
= protoni ≠ neutroni
Isotopi
Gli isotopi sono atomi che hanno lo stesso numero atomico (quindi hanno le stesse caratteristiche chimiche) ma con un diverso numero di neutroni si chiamano isotopi. Questo consente loro di poter essere isolati e identificati.
Quasi tutti gli elementi posseggono isotopi.
L’idrogeno ad esempio ha tre isotopi:
- 0H, il prozio, il più abbondante in natura, non ha neutroni;
- 2H, il deuterio, ha un neutrone;
- 3H, il trizio, ha due neutroni;
Il Carbonio a tre isotopi (12C, 13C,14C); l’Ossigeno ha tre isotopi (16O, 17O, 18O); l’Uranio ha diversi isotopi di cui i più diffusi sono 234U,235U,236U.
Alcuni isotopi sono instabili e tendono a decadere in una forma atomica stabile. Questo processo avviene attraverso l’emissione di energia sotto forma di radiazioni alfa, beta o gamma, sono cioè radioattivi. Tali isotopi naturali possono essere usati in geologia per la datazione delle rocce; in paleontologia per la datazione dei fossili; in medicina poiché sono nocivi per alcune cellule cancerogene; in biologia vengono usati come traccianti per individuare e studiare alcune tappe della fotosintesi.
Gli atomi sono elettricamente neutri perché il numero dei protoni è uguale a quello degli elettroni
Concetto di elemento
Gli elementi costituiscono la base della materia e sono composti da atomi tutti uguali che hanno lo stesso numero atomico (cioè lo stesso numero di protoni), ma possono avere diverso numero di massa (cioè diverso numero di protoni + neutroni).
L’elemento non può essere scomposto. Per esempio l’idrogeno è formato solo da atomi di idrogeno. La parte più piccola degli elementi sono gli atomi. Gli atomi mantengono inalterate le proprietà chimiche dell’elemento.
Quando due elementi chimici si combinano, si crea un composto, il composto chimico.
Nella Tavola Periodica vengono classificati gli elementi chimici presenti sulla Terra (92) più quelli scoperti artificialmente dall’uomo.

Elettroni
In base alle conoscenze della fisica moderna, non è possibile stabilire contemporaneamente la posizione e la velocità degli elettroni, ma è possibile individuare la regione attorno al nucleo dove essi si trovano.
Gli elettroni di un atomo si trovano nella nuvola elettronica che si trova introno al nucleo, all’interno del quale essi si distribuiscono in “livelli” che corrispondono a determinati stati di energia.
Il primo livello – è il livello più prossimo al nucleo ed è quello con il minore stato di energia, perché ospita il minor numero di elettroni per livello; mentre, man mano che ci si allontana dal nucleo i livelli contengono uno stato di energia via via maggiore.
Ogni livello contiene un numero massimo di elettroni: 2 al primo livello; 8 al secondo, 18 al terzo etc etc.
Il riempimento dei vari livelli avviene sempre in modo progressivo: gli elettroni tendono a saturare prima il livello a minore energia e poi, quando questo è completato, passano a completare via via a tutti gli altri.
La maggiore o minore stabilità di un atomo dipende dal grado di saturazione del suo livello energetico più esterno. I gas nobili sono considerati chimicamente inerti, cioè stabili, perché reagiscono molto difficilmente con gli altri elementi.
Legami chimici
Raramente in natura un atomo si trova allo stato libero. Due o più atomi dello stesso elemento o di elementi diversi tendono quasi sempre a combinarsi per realizzare il massimo stato di stabilità, simile a quello dei gas nobili, formano delle molecole. I legami chimici sono dunque le forze che consentono agli atomi di legarsi l’uno all’altro per avere stabilità.
I legami chimici tra gli atomo avvengono durante una reazione chimica tra gli elettroni del livello più esterno. Nella reazione chimica avviene uno scambio di energia che può essere di maggiore o minore entità a seconda della molecola che si forma.
Stato fondamentale e stato eccitato
Quando un atomo viene investito da una qualsiasi radiazione, l’energia trasmessa viene assorbita dagli elettroni che passano da uno Stato fondamentale a uno Stato eccitato, cioè ad un livello di energia maggiore.
Radiazioni
La radiazione è un’onda energetica che si muove nello spazio. Le radiazioni sono di vario tipo e sono classificate in base alla loro energia, cioè in base alla capacità che hanno di innescare le reazioni chimiche.
A seguire la classifica delle radiazioni in ordine di decrescente di energia:
- Raggi Gamma
- Raggi X
- Raggi Ultravioletti
- Raggi invisibili
- Raggi Infrarossi
- Microonde
- Onde Radio
L’atomo tuttavia, una volta colpito da una radiazione, non può rimanere a lungo allo stato eccitato e tende a ritornare allo stato fondamentale: ciò avviene con l’emissione dell’energia precedentemente catturata.
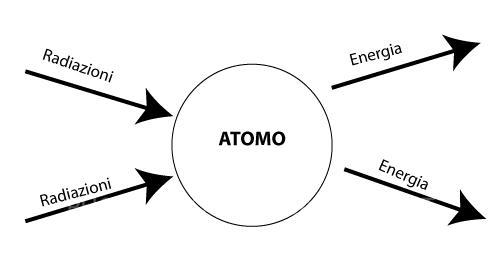
Questo è ciò che succede ad esempio alla molecola di clorofilla, quando gli atomi che la costituiscono vengono colpiti dalla luce solare, essi passano da uno stato di quiete a uno eccitato e diventano “capaci” di realizzare il processo fotosintetico.
Reazioni nucleari
Il livello energetico degli elettroni di un atomo dunque può mutare, mentre il nucleo dell’atomo non subisce alcuna modifica anche nel corso della reazione chimica.
Il nucleo si trasforma solo nelle reazioni nucleari che si verificano, ad esempio, all’interno di una stella, nei materiali radioattivi o nei reattori nucleari.
- LEGGI ANCHE: I corpi celesti
Reazioni chimiche → Nuvola elettronica
Reazioni nucleari → Nucleo
Molecole organiche e inorganiche
- Le molecole inorganiche (acqua, anidride carbonica…) sono molecole a basso contenuto energetico;
- Le molecole organiche (glucidi, protidi, lipidi…) sono molecole ad alto contenuto energetico.
Le molecole quando vengono demolite nelle reazioni chimiche liberano l’energia di legame richiesta per la loro formazione.
Tale energia può essere riutilizzata per la formazione di nuove molecole se la reazione avviene in un sistema ben organizzato a trarne profitto.
Le cellule viventi ad esempio sono dei sistemi altamente organizzati capaci di trasformare l’energia di legame in altre forme di energia.
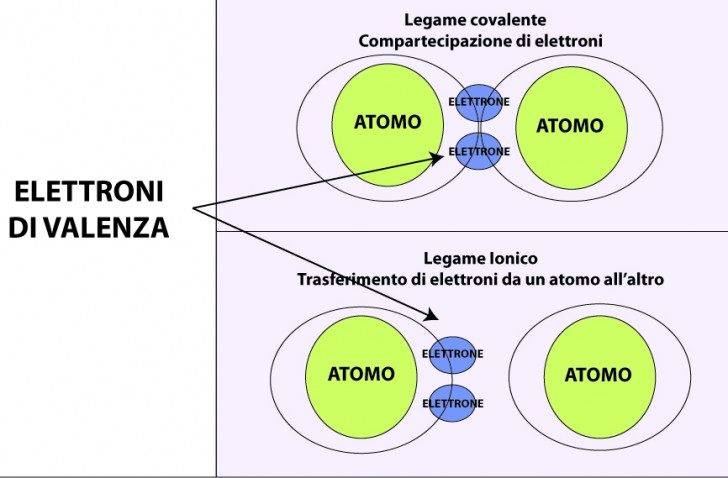
Legame ionico e legame covalente
Quando due o più atomi si combinano tra loro, si possono realizzare due tipi di legame chimico:
- Il legame covalente : si realizza quando gli atomi interessanti mettono in comune gli elettroni del loro livello più esterno. In questo caso gli elettroni messi in comune entrano a far parte della nuvola elettronica di ciascun atomo.
- Il legame ionico : si realizza quando gli elettroni si trasferiscono da un atomo all’altro. Gli elettroni non sono condivisi nella stessa nuvola elettronica ma entrano a far parte della nuvola elettronica dell’atomo che li attrae.
Gli ioni
Gli ioni sono atomi che hanno un numero diverso di protoni ed elettroni. Questi atomi non sono dunque neutri e tendono a perdere o ad acquisire gli elettroni per raggiungere la stabilità.
Gli elettroni che sono interessati da questo trasferimento sono quelli appartenenti ai livelli più esterni. Un atomo è elettricamente neutro quando il numero degli elettroni è uguale al numero dei protoni, ovvero quando cariche negative e positive si equivalgono.
In condizioni particolari tuttavia un atomo può cedere o acquistare un elettrone per raggiungere la massima stabilità . Un atomo che scambia elettroni cambiando le proprie proprietà chimiche diventa una ione, un atomo cioè che ha perduto o ha acquistato degli elettroni.
- Se un atomo perde elettroni, il numero dei protoni risulta maggiore ed assume una carica positiva. Un atomo che perde elettroni si chiama catione;
- Se un atomo acquista elettroni, esso diventa un anione, ovvero un atomo con carica negativa.
Il valore della carica positiva o negativa dell’atomo dipende dal numero di elettroni che l’atomo perde o acquisisce.
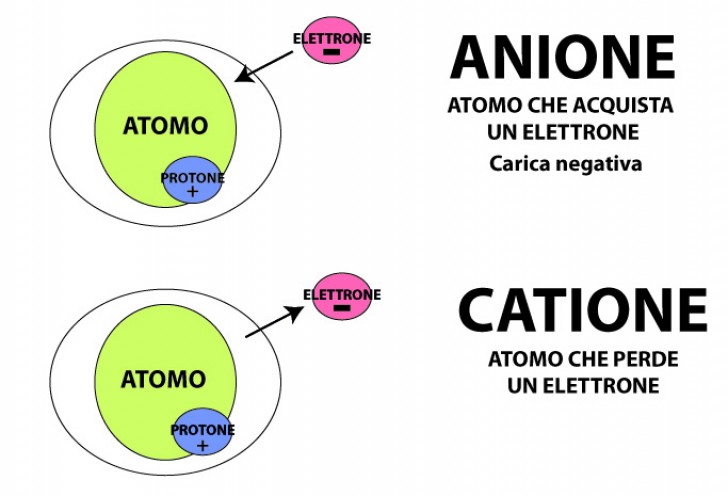
Rappresentazione simbolica dello ione
Uno ione si indica con il simbolo dell’elemento (o con i simboli del gruppo di elementi che lo compongono), cui si aggiunge in alto a destra un segno + se è un catione, o un segno – se è un anione.
- Per esempio lo ione idrogeno si scrive H+ , lo ione sodio Na+ , lo ione solfato SO4— .
Gli elementi i cui atomi tendono a diventare degli ioni positivi si dicono elettropositivi (per es. i metalli); gli elementi i cui atomi tendono a diventare degli ioni negativi si dicono elettronegativi (per es. i non metalli).
Due ioni con cariche elettriche di segno opposto si attraggono e formano un composto ionico: tipici composti ionici sono gli acidi, le basi e i Sali.
Dissociazione elettrolitica
La dissociazione elettrolitica è lo scioglimento parziale o completo di una molecola. La dissociazione produce cationi o anioni.
Sono esempi di composti ionici il sale da cucina (Na+ Cl–), l’acqua (H2O), il carbonato di calcio (Ca CO3) etc.
Tutti i composti ionici si possono dissociare: così ad esempio le molecole del sale da cucina si scioglie in acqua dissociandosi nei suoi atomi diversi perché il legame ionico che tiene unito sodio e cloro si spezza.
L’importanza di questo meccanismo è fondamentale in biologia perché variazioni anche lievi nella concentrazione degli ioni possono influenzare le reazioni cellulari fondamentali.







































