I sistemi dispersi sono i miscugli complessi, detti anche composizioni chimiche, costituiti dalla mescolanza di due o più sostanze tra cui non avviene nessuna reazione chimica e pertanto non si realizza mai alcun composto.
- LEGGI ANCHE: Sistemi dispersi, test
Sistema disperso
miscuglio di sostanze
senza reazione chimica
- LEGGI ANCHE: ATOMI E MOLECOLE
- LEGGI ANCHE: LA MATERIA E L’ENERGIA
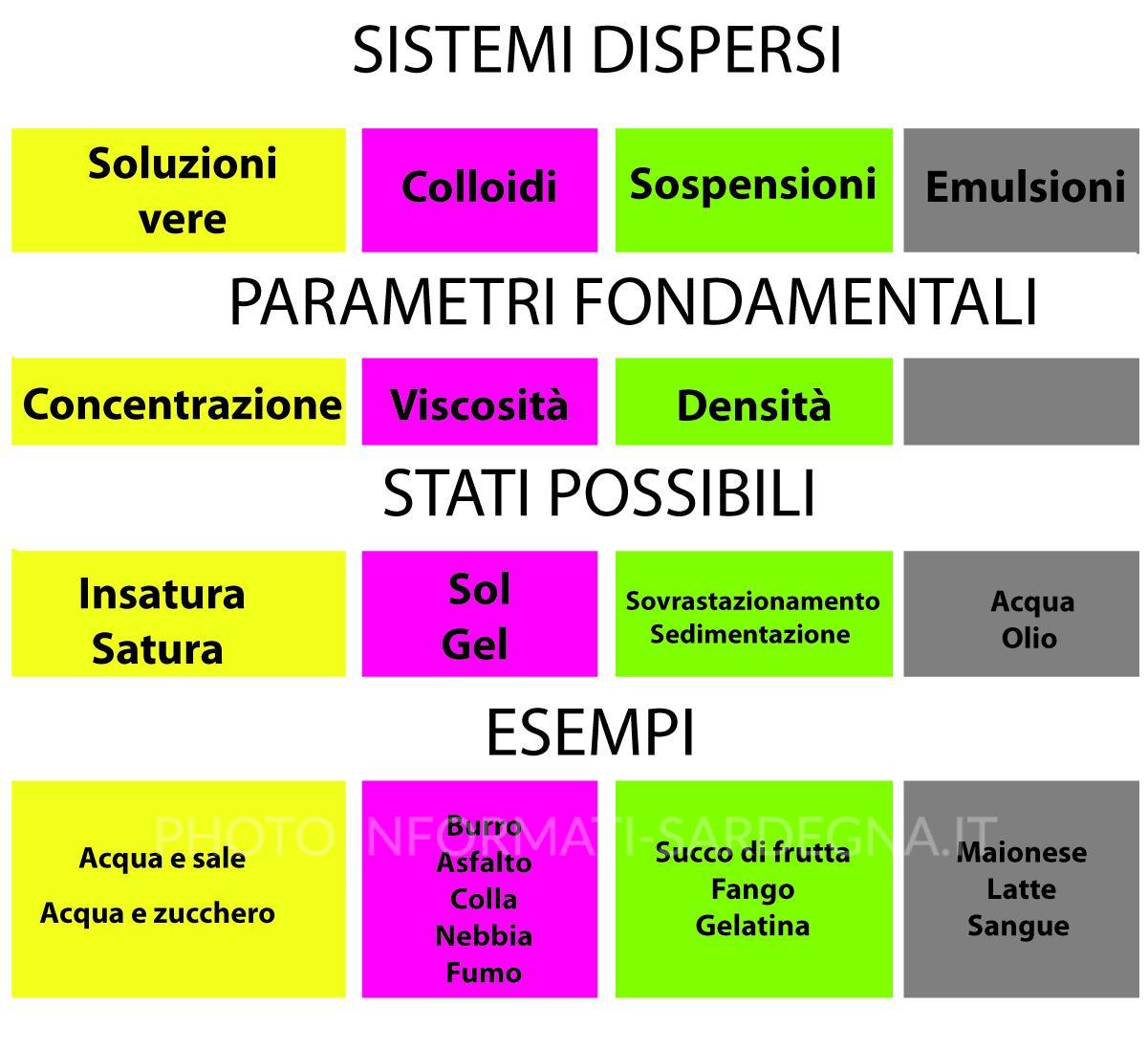
I sistemi dispersi possono essere classificati in base alle proprietà fisiche dei componenti (sistemi omogenei e sistemi eterogenei) o in base alle dimensioni delle particelle disperse che li compongono (soluzioni vere, collidi, sospensioni o emulsioni).
Classificazione dei sistemi in base alle proprietà fisiche
Sistemi dispersi omogenei
- Un esempio di sistemi dispersi omogenei sono le Soluzioni vere.
- Sono esempi di sistemi dispersi eterogenei i Colloidi, le Emulsioni e le Sospensioni.

Classificazione dei sistemi dispersi in base al diametro delle particelle
- le soluzioni vere – diametro inferiore a 10-7 cm – non osservabili al microscopio elettronico
- i colloidi – diametro compreso fra 10-5 cm e 10-7 cm – visibili all’ultramicroscopio
- le sospensioni – diametro maggiore di 10-5 cm – visibili al microscopio
- le emulsioni – diametro maggiore di 10-5 cm – visibili al microscopio
Soluzioni vere
 Le soluzioni vere sono una mescolanza trasparente, omogenea e otticamente vuota, che hanno particelle disciolte estremamente piccole.
Le soluzioni vere sono una mescolanza trasparente, omogenea e otticamente vuota, che hanno particelle disciolte estremamente piccole.
In una soluzione vera vi sono due fasi: il solvente ovvero il liquido disperdente e il soluto ovvero la sostanza disciolta.
- Parametro fondamentale per studiare le soluzioni vere è la concentrazione, ovvero la quantità di soluto presente in un certo volume di solvente.
Secondo l’indice di concentrazione dunque una soluzione si può dire satura se la concentrazione è massima e non è più possibile sciogliere altro soluto; insatura quando invece la concentrazione è parziale ed è ancora possibile per quel volume di liquido ospitare altro soluto.
Soluzioni colloidali
 Le sostanze che con l’acqua danno delle mescolanze simili a colle e in cui il soluto non si separa mai si chiamano soluzioni colloidali.
Le sostanze che con l’acqua danno delle mescolanze simili a colle e in cui il soluto non si separa mai si chiamano soluzioni colloidali.
In una soluzione colloidale il solvente è chiamato fase disperdente mentre il soluto è chiamato fase dispersa.
- Parametro fondamentale per studiare le soluzioni colloidali è la viscosità . Se l’acqua è abbondante la soluzione è un sol, se il volume d’acqua è saturo la soluzione diventa gel, che è molto vischioso.
Trasformazioni colloidali
Le soluzioni colloidali possono essere trasformate in gel o sol, o viceversa, attraverso processi naturali o con l’intervento dell’uomo (manipolazioni).
La trasformazione può essere reversibile o irreversibile. E pertanto:
- I colloidi reversibili, sono quelli che subiscono una trasformazione instabile e possono ritornare allo stato iniziale.
- I colloidi irreversibili, sono quelli che subiscono una trasformazione definitiva e non possono ritornare allo stato iniziale.

Sospensioni
Le sospensioni sono mescolanze eterogenee instabili e otticamente piene che consistono in una fase disperdente, il liquido, e in una fase dispersa, il solido.
Una sospensione essendo un sistema eterogeneo instabile, lasciando riposare i componenti si separano secondo lo loro densità e, mentre la fase solida decanta e sedimenta verso il fondo, quella liquida invece rimane sovrastante.
Emulsioni
Le sostanze oleose non si mescolano con l’acqua, ma i due liquidi restano separati da una superficie netta: non sono cioè miscibili. Scuotendo fortemente una mescolanza di questo tipo, si ottiene un liquido quasi omogeneo dall’aspetto lattiginoso detto emulsione.
Un’emulsione è un sistema eterogeneo instabile con una fase disperdente, l’acqua, e una fase dispersa, l’olio. È possibile stabilizzare l’emulsione attraverso l’aggiunta di soda, sapone o bile.

Latte
Sotto il profilo della composizione chimica, il latte è un insieme di sostanze nutritive che, a seconda della fase dispersa, si può presentare in quattro tipologie di sistema disperso:
- ha una fase di soluzione vera – perchè contiene proteine a basso peso molecolare, lattosio, vitamine idrosolubili e Sali minerali;
- ha una fase di soluzione colloidale – perchè è un aggregato di proteine ad alto peso molecolare come le micelle caseiniche
- ha una fase in sospensione – perchè ha disciolte in esso cellule e microrganismi
- ha una fase in emulsione – perchè ha una frazione grassa con vitamine idrosolubili
Autore dell’articolo: Pierpaolo Spanu









