I metalli sono gli elementi chimici situati a sinistra della tavola periodica (colore blu chiaro) e sono gli elementi chimici più numerosi sulla terra, oltre 80. A temperatura ambiente i metalli si trovano quasi tutti allo stato solido, tranne il mercurio che è liquido.
- LEGGI ANCHE: LA TAVOLA PERIODICA DEGLI ELEMENTI
- LEGGI ANCHE: I METALLI PESANTI
- la conducibilità dei metalli
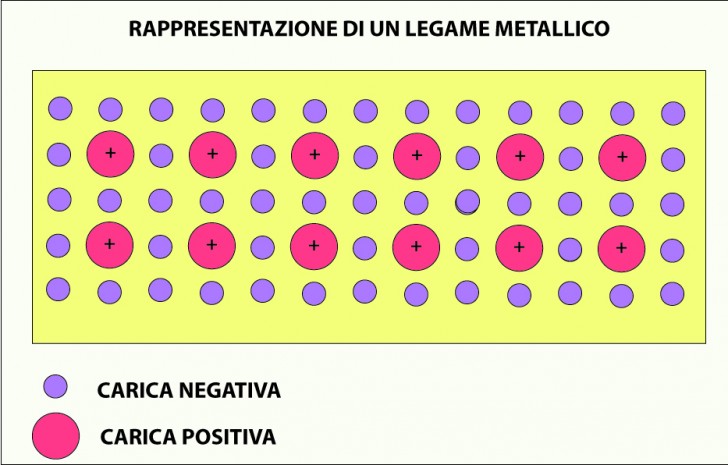
 Da un punto di vista chimico i metalli hanno la tendenza a perdere facilmente gli elettroni, specialmente i metalli alcalini e gli alcalini-terrosi. Questa peculiarità conferisce ai metalli il loro alto livello di conducibilità elettrica che è tanto maggiore quanto maggiore è il livello di purezza del cristallo.
Da un punto di vista chimico i metalli hanno la tendenza a perdere facilmente gli elettroni, specialmente i metalli alcalini e gli alcalini-terrosi. Questa peculiarità conferisce ai metalli il loro alto livello di conducibilità elettrica che è tanto maggiore quanto maggiore è il livello di purezza del cristallo.
Ad essere interessati alla perdita degli elettroni sono gli orbitali più esterni degli atomi che hanno uno o al massimo due elettroni negli orbitali più esterni, i cosiddetti “elettroni di valenza“. Invece, i metalli i cui atomi, hanno nei loro orbitali un numero maggiore di elettroni perdono via via la loro “metallicità ” e tendono ad essere classificati come non metalli.
Ad avere caratteristiche spiccatamente metalliche, sono prima di tutti i metalli di transizione, che sono quel gruppo di quaranta metalli che occupano i gruppi da 3 a 12 della Tavola Periodica. Questi elementi, avendo l’ultimo orbitale incompleto tendono a dar luogo a elevata coesione (legame metallico) e quindi ad avere temperatura di fusione e proprietà meccaniche elevate che conferendo loro grande importanza tecnologica.
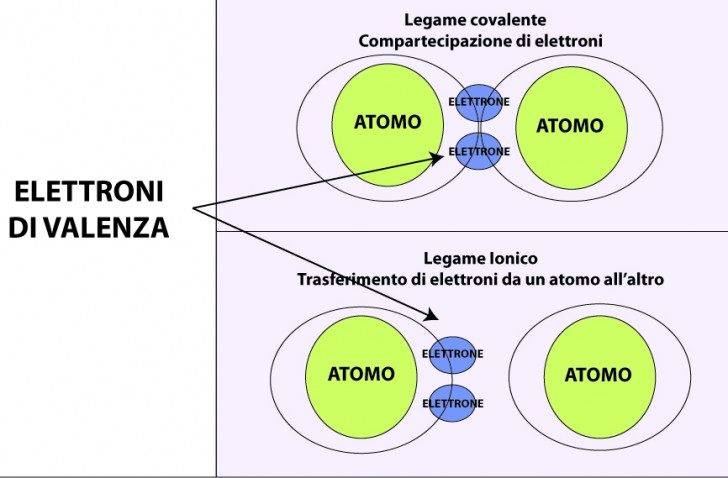
Da un punto di vista fisico il legame metallico di questi elementi è dovuto alla interazione attrattiva elettrostatica che si stabilisce tra gli elettroni e i protoni.
Autore dell’articolo: Pierpaolo Spanu